A RADIOATIVIDADE QUE SALVA VIDAS
A radioatividade que salva vidas
Autor: Fábio Luiz Navarro Marques
Para muitas pessoas, a palavra “radioatividade” é sinônimo de doença e morte. Embora parcialmente verdade, isso somente acontece em eventos extremos. Na prática, a radioatividade tem sido utilizada em benefício da humanidade: geração de energia elétrica, controle de processos industriais, na agricultura e na medicina, onde tem ajudado a curar doenças.
A aplicação da radioatividade na área de saúde foi possível a partir de estudos iniciados por Marie Curie (Prêmio Nobel em 1903 e 1911) que, juntamente com seu marido Pierre Curie (que com ela dividiu o Nobel de 1903), lançaram as bases da radioquímica e da radioanálise ao utilizarem a deteção da radioatividade para indicar onde estava o material de interesse. No estudo inicial, o casal Curie percebeu que amostras brutas do minério pitchblende eram mais radioativas que amostras de urânio purificado, obtidas do mesmo minério, e concluíram que deveria haver ali outro elemento que também emitisse radioatividade. Assim, Madame Curie pôs-se em árduo trabalho de separação, conseguindo obter 9 ng de polônio, a partir de 100 g do mineral, e 100 mg de rádio, processando toneladas de pitchblende.
 Depois desse trabalho, outros pesquisadores seguiram estudando o fenômeno da radioatividade, como o físico e químico Ernest Rutherford (Nobel de 1908), que realizou a transmutação de elementos, produzindo oxigênio a partir da reação de partículas alfa com átomos de nitrogênio. Esta mesma reação foi utilizada por Irène Curie (filha de Ma-rie) e seu marido, Frédéric Joliot (Nobel de 1935) para produzir o primeiro radioisótopo artificial, o fósforo-30. Ainda neste campo, o físico Ernest Lawrence (Nobel de 1939) desenvolveu o ciclotron, um sistema capaz de acelerar partículas, como íons de hidrogênio, deuté- rio e alfa, permitindo a criação de novos radioisótopos artificiais. Outro importante trabalho foi realizado pelo químico George de Hevesy (Nobel de 1943), que utilizou radioisótopos para estudar o metabolismo de plantas e animais, lançando os fundamentos para as aplicações médicas dos radioisótopos. Por fim, a descoberta da fissão do urânio – fenômeno elucidado pelo químico Otto Hahn (Nobel de 1944) –, que permitiu a construção dos reatores nucleares, responsáveis pela produção de energia elétrica e radioisótopos.
Depois desse trabalho, outros pesquisadores seguiram estudando o fenômeno da radioatividade, como o físico e químico Ernest Rutherford (Nobel de 1908), que realizou a transmutação de elementos, produzindo oxigênio a partir da reação de partículas alfa com átomos de nitrogênio. Esta mesma reação foi utilizada por Irène Curie (filha de Ma-rie) e seu marido, Frédéric Joliot (Nobel de 1935) para produzir o primeiro radioisótopo artificial, o fósforo-30. Ainda neste campo, o físico Ernest Lawrence (Nobel de 1939) desenvolveu o ciclotron, um sistema capaz de acelerar partículas, como íons de hidrogênio, deuté- rio e alfa, permitindo a criação de novos radioisótopos artificiais. Outro importante trabalho foi realizado pelo químico George de Hevesy (Nobel de 1943), que utilizou radioisótopos para estudar o metabolismo de plantas e animais, lançando os fundamentos para as aplicações médicas dos radioisótopos. Por fim, a descoberta da fissão do urânio – fenômeno elucidado pelo químico Otto Hahn (Nobel de 1944) –, que permitiu a construção dos reatores nucleares, responsáveis pela produção de energia elétrica e radioisótopos.
Atualmente são conhecidos mais de três mil radioisótopos produzidos em cíclotrons ou reatores. Destes, cerca de 30 são rotineiramente utilizados em medicina, tanto para o diagnóstico, quanto para tratamento de algumas doenças, principalmente o câncer. Em ambos os casos, os radioisótopos normalmente precisam ser incorporados a moléculas que os levem até o órgão a ser tratado. Por terem uma aplicação medicinal, são submetidos a processos de produção controlados e passam a ser chamados de radiofármacos.
Para uso em diagnóstico, a principal característica dos radioisótopos é emitir radiação eletromagnética (radiação gama) com energia apropriada para ultrapassar o tecido do corpo e ser detectada por equipamentos específicos.
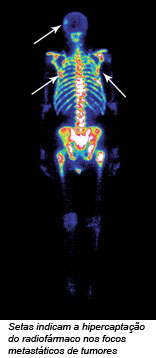
O principal radioisótopo utilizado no diagnóstico de várias doenças é o [99mTc] tecnécio, que é capaz de formar complexo organometálico com um grande número de ligantes. Como exemplos temos: o [[99mTc](OH)2 (MDP)2]2-, utilizado na cintilografia óssea (Na figura ao lado, as setas indicam a hipercaptação do radiofármaco nos focos metastáticos de tumores); o [[99mTc] O(ECD)], utilizado em estudos de perfusão cerebral, permitindo detectar doenças com Alzheimer, epilepsia e outras alterações no fluxo e metabolismo cerebral; [[99mTc] (MIBI)6]+, utilizado em estudos de perfusão do miocárdio permitindo localizar regiões de isquemia antes que ocorra um infarto.
Um radiofármaco que tem seu uso em expansão no Brasil, graças ao au mento no número de cíclotrons, é a (18F) fluorodeoxiglicose [(18F)FDG], um análogo da glicose com um átomo de (18F)flúor na posição 2 da molécula. A principal utilização da (18F)FDG é na detecção de tumores e é baseada na maior taxa de consumo de glicose pelas células tumorais, quando comparada às células normais. Vários outros compostos com (18F)flúor são produzidos. Um que deve estar disponível em breve no Brasil é a (18F)fluorotimidina [(18F)FLT], utilizada para avaliar se as células de um tumor estão se multiplicando. Com o uso destes dois radiofármacos é possível avaliar efetivamente a eficácia do tratamento quimioterápico, uma vez que alguns tumores, apesar de não se multiplicarem mais depois do tratamento, continuam consumindo glicose.
Para utilização no tratamento do câncer, os radioisótopos devem emitir partículas alfa ou beta. Elas possuem grande energia e são capazes de provocar danos irreversíveis às células tumorais, levando-as a morte. Todavia, há de ser considerado que essas partículas também podem atingir células saudáveis, daí a necessidade de que os radio isótopos estejam ligados a moléculas que possam se concentrar principal mente na superfície ou no interior das células tumorais. Com esta condição, a maioria dos radiofármacos para tera pia são anticorpos ou peptídeos, conjugados a grupos quelantes que coordenam metais como o (90Y)ítrio e o 177Lu (lutécio), ainda que existam radiofármacos complexados com moléculas mais simples, como o [[153Sm](EDT MP)]2- ou o uso do sal 223RaCl2.
Ipen - No Brasil, as atividades com radioisótopos começaram em 1949, com a criação do Laboratório de Isótopos da Faculdade de Medicina da USP, dirigido pelo casal Tedd e Verônica Eston. Já o primeiro reator nuclear para produção de radioisótopos da América Latina foi inaugurado, em 1958, no Instituto de Pesquisas Energéticas e Nucleares, em São Paulo (Ipen/SP), e está em funcionamento até hoje. Com a crescente demanda por radioisótopos, em quantidade e variedade, o Ipen/SP planeja construir um novo reator, na cidade de Iperó/SP. Na área de cíclotrons, após mudanças legais, empresas privadas e de economia mista puderam insta-lar seus próprios equipamentos. Assim, além daquela pertencente ao Ipen e a da administrada pelo Instituto Nacional de Energia Nuclear (IEN/RJ), o País passou a contar com unidades no Centro de Desenvolvimento da Energia Nuclear (CDTN/MG) e no Centro Regional de Ciências Nucleares (CRC N/PE). O setor privado possui outras três instalações: a da Villas Boas Radio fármacos (Brasília/DF), a da Cyclobras (Campinas/SP) e a da R2 Soluções em Radiofarmácia (Porto Alegre/RS). Existe, ainda, a unidade do Hospital das Clínicas de São Paulo, considerada de ca- ráter universitário por ter forte viés de pesquisa, que se dedica ao atendimento dos pacientes da rede pública de saúde.
O aumento do número de instalações reflete a forte demanda pelo uso de materiais radioativos na área de saúde. Por decorrência, tal cenário representa uma oportunidade ímpar para os profissionais da química que tenham interesse em trabalhar neste campo.
Radioisótoposmas utilizados e suas finalidades
| Radioisótopo | Meia-vida | Produção | Tipo decaimento | Energia (MeV) | Uso |
| 99mTC | 6,02 h | Gerador | gama | 0,14 | Diagnóstico |
| 11C | 20,3 min | Ciclotron | Positron (gama) | 0,96 (0,511) | Diagnóstico |
| 18F | 110 min | Ciclotron | Positron (gama) | 063 (0,511) | Diagnóstico |
| 54Cu | 12,7 h | Ciclotron | Positron (gama) | 0,653 (0,511) | Diagnóstico |
| 90Y | 2,67 d | Reator | Beta | 2,28 | Terapia |
| 124I | 4,18 d | Ciclotron | Positron (gama) | 2,15 (0,511) | Diagnóstico |
| 131I | 8d | Reator | Beta/gama | 0,806/0,364 | Terapia |
| 153SM | 1,95 d | Reator | Beta/gama | 0,809/0,103 | Terapia |
| 177Lu | 6,75 d | Reator | Beta/gama | 050/0,113 | Terapia |
| 211At | 7,21 min | Ciclotron | Alfa/Captura de elétrons | 7,45/0,688 | Terapia |
| 223Ra | 11,4 d | Gerador | Alfa | 5,99 | Terapia |
Também aumenta consideravelmente a possibilidade de realização de pesquisa como, por exemplo, a utilização de moléculas marcadas com (11C)carbono, (18F)flúor ou outros metais, como o (64Cu)cobre, com realização de estudos farmacocinéticos e farmacodinâmicos em modelos animais, através da visualização da distribuição dos produtos em tempo real, e da possibilidade de quantificação da concentração dos produtos, em cada órgão, em cada fração de tempo.
|
Doutor em Ciências (oncologia), o Bacharel em Química Fábio Luiz Navarro Marques é responsável pelo Laboratório de Radiofarmácia do Inst. de Radiologia do Hospital das Clínicas da Faculdade de Medicina - USP e organizador da IV Escola de Inverno de Radiofarmácia e Radioquímica, evento marcado para julho (veja detalhes no site do Conselho). Contatos podem ser feitos pelo e-mail fabio.marques@hc.fm.usp.br.
|
- Início
- contato
- VIVA
- AR
- ÁGUA
- LINKS IMPORTANTES
- mensagens do professor
- TRABALHOS
- CAL
- CIENCIA
- EXPERIMENTOS
- PH
- COMBUSTIVEIS
- TEORIAS ATOMICAS
- PROVAS DO ENEM CORRIGIDAS
- TRANSFORMAÇÕES QUÍMICAS
- TRANSFORMAÇÕES FÍSICAS
- EXERCÍCIOS SOBRE MISTURAS
- MISTURAS
- DISTRIBUIÇÃO ELETRÔNICA
- ÁTOMO
- QUÍMICA VIVA
- VARIEDADES ALOTRÓPICAS DO CARBONO
- ALUNOS DA 8º SÉRIE
- ECONOMIZAR ÁGUA
- AMIANTO
- A RADIOATIVIDADE QUE SALVA VIDAS
- A QUÍMICA DO AÇÚCAR
- "ÓXIDO NITROSO" TUDO A VER COM O AMOR
- OS METAIS E A SAÚDE HUMANA
- ALUMÍNIO
- EXERCÍCIOS DE ATOMISTICA
- DESAFIOS
- TABELA PERIÓDICA
- REFRIGERANTES
- VIAGRA
- LAVOISIER
- EXERCÍCIOS DE LIGAÇÕES QUÍMICAS
- GEOMETRIA MOLECULAR
- EXERCÍCIOS
- EXERCÍCIOS SOBRE TABELA PERIÓDICA
- EXERCÍCIOS SOBRE FUNÇÕES INORGÂNICAS
- (Página sem titulo)
- ESTEQUIOMETRIA
- BALANCEAMENTO
- EXERCÍCIOS ISOMERIA PLANA
- EXERCÍCIOS MISTURAS 2016
- LIGAÇÃO QUÍMICA
- EVOLUÇÃO DOS MODELOS ATÔMICOS
- FUNÇÕES INORGÂNICAS
- CINÉTICA QUÍMICA
- ELETROQUÍMICA
- Contactos
Total de visitas: 146453

