DISTRIBUIÇÃO ELETRÔNICA
DISTRIBUIÇÃO ELETRÔNICA
Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
Solução:
Se Z=25 isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
K - 1s2
L - 2s2 2p6
M - 3s2 3p6 3d5
N - 4s2 4p 4d 4f
O - 5s 5p 5d 5f
P - 6s 6p 6d
Q - 7s 7p
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Solução:
K - 1s2
L - 2s2 2p6
M- 3s2 3p6 3d10
N- 4s2 4p6 4d10 4f
O- 5s2 5p6 5d 5f
P- 6s 6p 6d
Q- 7s 7p
Resposta: K=2; L=8; M=18; N=18; O=8
Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling.

Segundo Böhr, o átomo pode ter no máximo 7 camadas. Qual delas é a mais energética?
a) camada K
b) camada L
c) camada N
d) camada P
e) camada Q
Distribuição Eletrônica de Elétrons
Os elétrons estão distribuídos em camadas ao redor do núcleo. Admite-se a existência de 7 camadas eletrônicas, designados pelas letras maiúsculas:
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
K,L,M,N,O,P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
Por meio de métodos experimentais, os químicos concluíram que o número máximo de elétrons que cabe em cada camada ou nível de energia é:
| Nível de energia | Camada | Número máximo de elétrons |
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 2 (alguns autores admitem até 8) |
Em cada camada ou nível de energia, os elétrons se distribuem em subcamadas ou subníveis de energia, representados pelas letras s,p,d,f, em ordem crescente de energia.
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
O número máximo de elétrons que cabe em cada subcamada, ou subnivel de energia, também foi determinado experimentalmente:
energia crescente
---------------------------------->
---------------------------------->
| Subnível | s | p | d | f |
| Número máximo de elétrons | 2 | 6 | 10 | 14 |
O número de subníveis que constituem cada nível de energia depende do número máximo de elétrons que cabe em cada nível. Assim, como no 1ºnível cabem no máximo 2 elétrons, esse nível apresenta apenas um subnível s, no qual cabem os 2 elétrons. O subnível s do 1º nível de energia é representado por 1s.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Como no 2º nível cabem no máximo 8 elétrons, o 2º nível é constituído de um subnível s, no qual cabem no máximo 2 elétrons, e um subnível p, no qual cabem no máximo 6 elétrons. Desse modo, o 2º nível é formado de dois subníveis, representados por 2s e 2p, e assim por diante.
Resumindo:
| Nível | Camada | Nº máximo de elétrons | Subníveis conhecidos |
| 1º | K | 2 | 1s |
| 2º | L | 8 | 2s e 2p |
| 3º | M | 18 | 3s, 3p e 3d |
| 4º | N | 32 | 4s, 4p, 4d e 4f |
| 5º | O | 32 | 5s, 5p, 5d e 5f |
| 6º | P | 18 | 6s, 6p e 6d |
| 7º | Q | 2 (alguns autores admitem até 8) | 7s 7p |
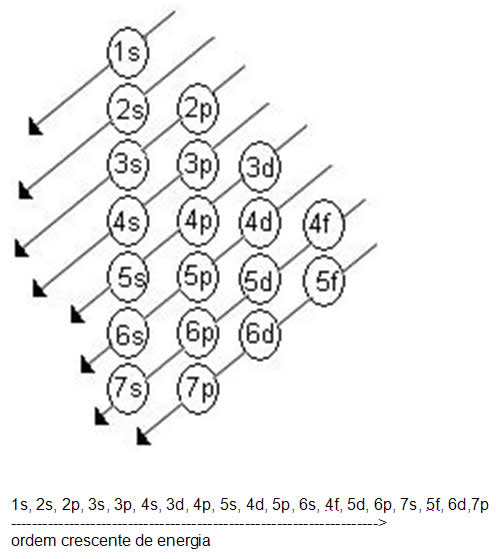
Linus Carl Pauling (1901-1994), químico americano, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na sequência das diagonais.

Acompanhe os exemplos de distribuição eletrônica:
1 - Distribuir os elétrons do átomo normal de manganês (Z=25) em ordem de camada.
Solução:
Se Z=25 isto significa que no átomo normal de manganês há 25 elétrons. Aplicando o diagrama de Pauling, teremos:
K - 1s2
L - 2s2 2p6
M - 3s2 3p6 3d5
N - 4s2 4p 4d 4f
O - 5s 5p 5d 5f
P - 6s 6p 6d
Q - 7s 7p
Resposta: K=2; L=8; M=13; N=2
2 - Distribuir os elétrons do átomo normal de xenônio (Z=54) em ordem de camada.
Solução:
K - 1s2
L - 2s2 2p6
M- 3s2 3p6 3d10
N- 4s2 4p6 4d10 4f
O- 5s2 5p6 5d 5f
P- 6s 6p 6d
Q- 7s 7p
Resposta: K=2; L=8; M=18; N=18; O=8
Há alguns elementos químicos cuja distribuição eletrônica não “bate” com o diagrama de Pauling.
Fonte: https://www.brasilescola.com/quimica/distribuicao-eletronica-de-eletrons.htm
Exercícios sobre distribuição eletrônica
1) Utilizando o diagrama de Pauling, realize a distribuição eletrônica do elemento tungstênio (W), cujo número atômico (Z) é igual a 74 e, posteriormente, forneça:
a) A distribuição eletrônica em ordem de energia;
b) A ordem geométrica;
c) O número total de elétrons por camada;
d) O número de elétrons no subnível mais energético;
e) O número de elétrons no subnível mais externo.
2) Faça a distribuição eletrônica em níveis de energia para os seguintes elementos:
a) 9F
b) 10Ne
c) 15P
d) 28Ni
e) 56Ba
3) (TA-SP) No esquema a seguir, encontramos duas distribuições eletrônicas de um mesmo átomo neutro:
A 1s2 2s2 B 1s2 2s1 2p1
A seu respeito é correto afirmar:
a) A é a configuração ativada.
b) B é a configuração normal (fundamental).
c) A passagem deA para B libera energia na forma de ondas eletromagnéticas.
d) A passagem de A para B absorve energia.
e) A passagem de A para B envolve perda de um elétron.
4) (UNI-RIO)“Os implantes dentários estão mais seguros no Brasil e já atendem às normas internacionais de qualidade. O grande salto de qualidade aconteceu no processo de confecção dos parafusos e pinos de titânio, que compõem as próteses. Feitas com ligas de titânio, essas próteses são usadas para fixar coroas dentárias, aparelhos ortodônticos e dentaduras, nos ossos da mandíbula e do maxilar.”
Jornal do Brasil, outubro 1996.
Considerando que o número atômico do titânio é 22, sua configuração eletrônica será:
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
5) Selecione a alternativa que preenche corretamente as lacunas no texto abaixo.
A chamada experiência de Rutherford (1911-1913), consistiu essencialmente em lançar, contra uma lâmina muito delgada de ouro, um feixe de partículas emitidas por uma fonte radioativa. Essas partículas, cuja carga elétrica é .........., são conhecidas como partículas .......... .
a) positiva - alfa
b) positiva - beta
c) nula - gama
d) negativa - alfa
e) negativa - beta
6) Böhr estabeleceu em sua teoria atômica que os elétrons giram em 7 órbitas circulares denominadas níveis ou camadas ao redor do núcleo, como mostra a seguinte ilustração:

Segundo Böhr, o átomo pode ter no máximo 7 camadas. Qual delas é a mais energética?
a) camada K
b) camada L
c) camada N
d) camada P
e) camada Q
7) No esquema abaixo encontramos duas distribuições eletrônicas de um mesmo átomo neutro.
1s2 2s2 1s2 2s1 2p1
A B
a) A é a configuração ativada.
b) B é a configuração normal.
c) A passagem de A para B liberta energia na forma de ondas eletromagnéticas.
d) A é um gás nobre.
e) A passagem de A para B absorve energia.
8) Analise o texto:
A energia de um subnível pode ser dada pela soma (n + l). Ocorrendo empates, terá maior energia o elétron com maior valor de n.”
Portanto:
a) O subnível 4s tem maior energia que o subnível 3d.
b) O subnível 4p tem menor energia que 4s.
c) Para um dado nível sempre o subnível s apresentará maior energia que os subníveis p, d ou f.
d) O subnível 6d tem maior energia que 7s.
e) Poderão existir dois subníveis com a mesma energia real.

A energia de um subnível pode ser dada pela soma (n + l). Ocorrendo empates, terá maior energia o elétron com maior valor de n.”
Portanto:
a) O subnível 4s tem maior energia que o subnível 3d.
b) O subnível 4p tem menor energia que 4s.
c) Para um dado nível sempre o subnível s apresentará maior energia que os subníveis p, d ou f.
d) O subnível 6d tem maior energia que 7s.
e) Poderão existir dois subníveis com a mesma energia real.
9) Na questão a seguir assinale a afirmativa INCORRETA.
a) Cada átomo possui níveis de energia que podem ser ocupados por seus elétrons.
b) Para todos os átomos de todos os elementos, os níveis de energia são iguais.
c) Os níveis de energia são quantizados, ou seja, o átomo deverá absorver ou emitir quantidades específicas de energia.
d) Para os elétrons mudarem de um nível de energia para outro, o átomo deverá absorver ou emitir energia.
10) No modelo atômico de BOHR para o átomo de hidrogênio, o elétron gira em órbita circular em volta do próton central. Supõe-se que o próton esteja em repouso em um referencial inercial. Essa hipótese da imobilidade do próton pode ser justificada porque o próton tem:
a) carga elétrica de sinal oposto à do elétron.
b) carga elétrica infinitamente maior que a do elétron.
c) massa igual à do elétron.
d) massa muito maior que a do elétron.
11) (ACAFE) Considerando-se um elemento M genérico qualquer, que apresenta configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d5, pode-se afirmar que:
I. seu número atômico é 25;
II. possui 7 elétrons na última camada;
III. apresenta 5 elétrons desemparelhados;
IV. pertencem a família 7A.
Estão corretas as afirmações:
a) I, II e III somente
b) I e III somente
c) II e IV somente
d) I e IV somente
e) II, III e IV somente
12) (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
13) (ITA) O número máximo de orbitais atômicos correspondente ao número quântico principal é:
a) n
b) 2n
c) 2n + 1
d) n2
e) 2n2
14) (OSEC) Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que:
I. o número total de elétrons desse átomo é igual a 19;
II. esse apresenta quatro camadas eletrônicas;
III. a sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s1
a) Apenas a firmação I é correta.
b) Apenas a firmação II é correta.
c) Apenas a firmação III é correta.
d) As afirmações I e II são corretas.
e) As afirmações II e III são corretas.
15) (CESCEM) Qual dos valores abaixo pode representar o número atômico de um átomo que, no estado fundamental, apresenta apenas dois elétrons de valência?
a) 16
b) 17
c) 18
d) 19
e) 20
16) (UDESC 2009)
Os elementos X e Y apresentam as seguintes configurações eletrônicas 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 e 1s2 2s2 2p6 3s2 3p6 4s1, respectivamente. O período e a família em que se encontram estes elementos são:
a) Os elementos X e Y pertencem ao quarto período, sendo que o elemento X pertence à família V A, enquanto e elemento Y pertence à família I A.
b) Os elementos X e Y pertencem ao quarto período, sendo que o elemento X pertence à família III A, enquanto e elemento Y pertence à família I A.
c) Os elementos X e Y pertencem à mesma família e ao mesmo período.
d) Os elementos X e Y pertencem ao terceiro e primeiro períodos respectivamente. Quanto à família os dois elementos pertencem à família IV A.
e) O elemento X é um elemento alcalino e o elemento Y é um halogênio.
Gabarito:
1) Distribuição eletrônica no diagrama de Pauling:

a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4
b) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2
c) K = 2; L = 8; M = 18; N = 32 ; O = 12; P = 2
d) O subnível mais energético é sempre o último a receber elétrons no diagrama de Pauling; logo, no átomo de tungstênio esse subnível é o 5d, apresentando 4 elétrons.
e) O subnível mais externo de um átomo é sempre aquele que se encontra mais afastado do núcleo, ou seja, localiza-se na camada de valência. No tungtênio temos 6 níveis de energia; logo, o subnível mais externo está localizado no nível 6 ou na sexta camada. Assim, os elétrons mais externos estão situados no subnível 6s, contendo 2 elétrons.
2)
a) 1s2 2s2 2p5

b) 1s2 2s2 2p6

c) 1s2 2s2 2p6 3s2 3p3

d) 1s2 2s2 2p6 3s2 3p6 4s2 3d8

e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2

3) D 4) D 5) A 6) E 7) E 8) D 9) B 10) D 11) B 12) A 13) D 14) D
15) E 16) A
b) 1s2 2s2 2p6

c) 1s2 2s2 2p6 3s2 3p3

d) 1s2 2s2 2p6 3s2 3p6 4s2 3d8

e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2

3) D 4) D 5) A 6) E 7) E 8) D 9) B 10) D 11) B 12) A 13) D 14) D
- Início
- contato
- VIVA
- AR
- ÁGUA
- LINKS IMPORTANTES
- mensagens do professor
- TRABALHOS
- CAL
- CIENCIA
- EXPERIMENTOS
- PH
- COMBUSTIVEIS
- TEORIAS ATOMICAS
- PROVAS DO ENEM CORRIGIDAS
- TRANSFORMAÇÕES QUÍMICAS
- TRANSFORMAÇÕES FÍSICAS
- EXERCÍCIOS SOBRE MISTURAS
- MISTURAS
- DISTRIBUIÇÃO ELETRÔNICA
- ÁTOMO
- QUÍMICA VIVA
- VARIEDADES ALOTRÓPICAS DO CARBONO
- ALUNOS DA 8º SÉRIE
- ECONOMIZAR ÁGUA
- AMIANTO
- A RADIOATIVIDADE QUE SALVA VIDAS
- A QUÍMICA DO AÇÚCAR
- "ÓXIDO NITROSO" TUDO A VER COM O AMOR
- OS METAIS E A SAÚDE HUMANA
- ALUMÍNIO
- EXERCÍCIOS DE ATOMISTICA
- DESAFIOS
- TABELA PERIÓDICA
- REFRIGERANTES
- VIAGRA
- LAVOISIER
- EXERCÍCIOS DE LIGAÇÕES QUÍMICAS
- GEOMETRIA MOLECULAR
- EXERCÍCIOS
- EXERCÍCIOS SOBRE TABELA PERIÓDICA
- EXERCÍCIOS SOBRE FUNÇÕES INORGÂNICAS
- (Página sem titulo)
- ESTEQUIOMETRIA
- BALANCEAMENTO
- EXERCÍCIOS ISOMERIA PLANA
- EXERCÍCIOS MISTURAS 2016
- LIGAÇÃO QUÍMICA
- EVOLUÇÃO DOS MODELOS ATÔMICOS
- FUNÇÕES INORGÂNICAS
- CINÉTICA QUÍMICA
- ELETROQUÍMICA
- Contactos
Total de visitas: 146427

