ÁTOMO
ÁTOMO
Tomando o modelo de Rutherford–Bohr como objeto de estudo, podemos definir alguns tópicos básicos que vão nortear nossos estudos.
A teoria de Dalton admitia que:
I. Átomos são partículas discretas de matéria que não podem ser divididas por qualquer processo químico conhecido;
II. Átomos do mesmo elemento químico são semelhantes entre si e têm mesma massa;
III. Átomos de elementos diferentes têm propriedades diferentes.
a) Somente I é correta.
b) Somente II é correta.
c) Somente III é correta.
d) I, II, III são corretas.
e) I e III são corretas.

O QUE É UM ÁTOMO ?
Todas as substâncias são feitas de matéria e a unidade fundamental da matéria é o átomo. O átomo constitui a menor partícula de um elemento.
Estrutura do átomo
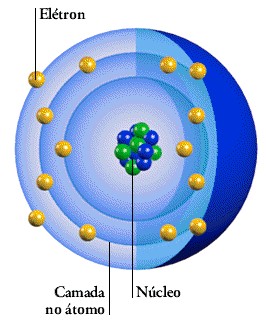
Um átomo é formado por um centro, que é fixo, chamado núcleo. É também formado por uma parte exterior com elétrons que giram à sua volta a uma grande velocidade. Estes elétrons formam camadas que ficam dispostas ao redor do núcleo, camadas essas que formam a nuvem eletrônica.
O núcleo do átomo é constituído por partículas positivas – os prótons e por partículas negativas – os nêutrons.

Na figura abaixo temos o exemplo de um átomo de sódio. No centro podemos ver o núcleo com o limite a tracejado, contendo no seu interior os prótons de cor azul (cargas positivas), e os nêutrons de cor verde (sem carga). Ao redor do núcleo vemos as várias camadas ou nuvens eletrônicas (K, L, M) contendo cada uma um determinado número de elétrons de cor vermelha (de carga negativa).
Estas camadas, ou órbitas, são denominadas com letras, começando do interior com a letra K, passando à camada seguinte com a letra L, depois a letra M e assim sucessivamente.
Nas camadas ou órbitas à volta do núcleo, cada uma delas tem um limite máximo de elétrons que pode suportar.
Sendo assim, o número máximo de elétrons que cada órbita pode suportar é de:
Primeira órbita (K) = até 2 elétrons
Segunda órbita (L)= até 8 elétrons
Terceira órbita (M) = até 18 elétrons (caso não seja a última órbita ou órbita de valência)
Quarta órbita (N) = até 32 elétrons (caso não seja a última órbita ou órbita de valência)
Segunda órbita (L)= até 8 elétrons
Terceira órbita (M) = até 18 elétrons (caso não seja a última órbita ou órbita de valência)
Quarta órbita (N) = até 32 elétrons (caso não seja a última órbita ou órbita de valência)
Como já disse, os elétrons são as partículas que giram à volta do núcleo. Na camada, ou órbita, mais afastada do núcleo, ou seja, na última camada exterior, giram também electrões, que recebem o nome de elétrons de valência. Nesta última camada, o limite máximo de electrões de valência é sempre de oito electrões.
Na figura podemos ver dois átomos. À esquerda o átomo de germânio e à direita o átomo de silício. Temos as várias camadas da nível eletrônica dispostas à volta do núcleo.
Dentro do núcleo temos, no caso do germânio, 32 cargas positivas – os prótons e no silício 14 prótons. Os nêutrons não são apresentados por terem carga neutra e serem praticamente irrelevantes. Cada um deles tem o mesmo número de prótons e elétrons e ambos têm também 4 elétrons de valência – elétrons da camada exterior.
Em eletrônica os elétrons com mais importância são os de elétrons de valência (os da camada exterior), já que estes são os que têm mais facilidade em se separar de um átomo para se unir a outro.
MODELOS ATÔMICOS
Modelo de Dalton (bola de bilhar) – 1803
Para John Dalton, a teoria de Leucipo e Demócrito era bastante coerente. Segundo este modelo, os átomos eram as menores partículas possíveis, assumiam formas esféricas e possuíam massa semelhante caso fossem correspondentes ao mesmo elemento químico.
Modelo de Thomson (pudim de passas) – 1897
Através da descoberta do elétron (partícula constituinte do átomo com carga elétrica negativa), o modelo de Dalton ficou defasado. Assim, com os estudos de Thomson, um novo modelo foi idealizado.
De acordo com este novo modelo, o átomo era uma esfera maciça de carga elétrica positiva incrustada com elétrons. Tornando-se assim eletricamente neutro.
Modelo de Rutherford-Bohr (sistema planetário) – 1908/1910
Rutherford ao bombardear partículas alfa sobre uma lâmina de ouro percebeu que a maioria atravessava a lâmina. Enquanto que uma menor parte sofria pequeno desvio, e uma parte ínfima sofria grande desvio contrário à trajetória.
A partir desse experimento, foi possível perceber que os átomos não eram maciços como se pensava, mas dotados de grande espaço vazio. Assim como, que eram constituídos por um núcleo carregado positivamente e uma nuvem eletrônica carregada negativamente. Essa nuvem eletrônica era composta por elétrons que giravam em órbitas elípticas ao redor do núcleo (assim como os planetas ao redor do sol).
Também constatou-se que a maior parte da massa de um átomo se concentra no núcleo (que rebatia as partículas alfa no sentido contrário do bombardeio).
Mas ainda havia um enigma: De acordo com a teoria das ondas eletromagnéticas, os elétrons ao girarem em torno do núcleo perderiam gradualmente energia, começariam a descrever um movimento helicoidal, e simplesmente cairiam no núcleo. Mas, como isso pode acontecer se os átomos são estruturas estáveis?
Dois anos após Rutherford ter exposto o seu modelo atômico, Niels Bohr o aperfeiçoou. A teoria de Bohr pode ser fundamentada em três postulados:
1) Os elétrons descrevem, ao redor do núcleo, órbitas circulares com energia fixa e determinada. Sendo denominadas órbitas estacionárias;
2) Durante o movimento nas órbitas estacionárias, os elétrons não emitem energia espontaneamente;
3) Quando um elétron recebe energia suficiente do meio externo, realiza um salto quântico: migra entre dois orbitais. E, como tende a voltar ao orbital inicial, a energia recebida é emitida na mesma quantidade para o meio. Sendo essa energia (recebida e emitida) a diferença energética entre os dois orbitais.
Apesar de bastante difundida no ensino médio, o modelo atômico de Rutherford-Bohr é, em parte, ineficiente. Pois:
- Os elétrons, na prática, não realizam trajetórias circulares ou elípticas ao redor do núcleo;
- Não deixa claro o porquê de os elétrons não perderem energia durante seu movimento;
- Não explica a eletrosfera de átomos que possuem muitos elétrons.
Assim, o modelo atômico ideal está sendo obtido a cada dia em que se descobrem mais informações acerca da estrutura íntima da matéria.
NÚMERO ATÔMICO E NÚMERO DE MASSA
Tomando o modelo de Rutherford–Bohr como objeto de estudo, podemos definir alguns tópicos básicos que vão nortear nossos estudos.
a) Número atômico (Z): n.° de prótons (P) no núcleo de um átomo.
O número atômico caracteriza um elemento químico.
b) Número de massa (A): O número de massa é a soma dos prótons (P) e nêutrons (N) do núcleo de um átomo.
A = P + N ou A = Z + N
Um átomo (X) será representado assim:
AzX ou zXA
c) Átomo neutro – Aquele em que o número de prótons é igual ao número de elétrons.
Exemplo: 11Na23 e 8O16
d) Íon: espécie química cujo número de prótons é diferente do número de elétrons.
Os cátions são formados por retiradas de um ou mais elétrons da eletrosfera de um átomo: íon carregado positivamente.
Exemplos:
2311Na1+ = perdeu 1 elétron
3517Cl1- = ganhou 1 elétron
Os ânions são formados quando adicionamos um ou mais elétrons à eletrosfera de um átomo: íon carregado negativamente.
Exemplos:
168O2- = ganhou 2 elétrons
3517Cl1- = ganhou 1 elétron
e) Isótopos – Átomos com o mesmo número atômico (número de prótons) e diferentes números de massa. Pertencem ao mesmo elemento químico. Os isótopos possuem propriedades químicas iguais e propriedades físicas diferentes.
Exemplo:
11H = Prótio ou hidrogênio leve
11H = Prótio ou hidrogênio leve
21H = Deutério
31H = Trítio
f) Isóbaros – Átomos com o mesmo número de massa (A). Os isóbaros possuem propriedades químicas e físicas diferentes.
Exemplo:
4019K e 4020Ca
Isótonos – Átomos com o mesmo número de nêutrons (N). Os isótonos possuem propriedades físicas e químicas diferentes.
Exemplo:
3717Cl e 4020Ca
h) Isoeletrônicos – Espécies químicas com o mesmo número de elétrons. Os isoeletrônicos possuem propriedades físicas e químicas diferentes.
Exemplo:
15P3 – e 20Ca2+ : ambos com 18 elétrons.
Peso Atômico (ou massa atômica relativa) de um elemento é o número de vezes que um átomo daquele elemento é mais pesado que um átomo de hidrogênio. O peso atômico do hidrogênio é tomado como sendo a unidade .
O que é matéria ?
Tudo aquilo que nos rodeia e ocupa um certo espaço tem o nome de matéria.
A parte mais pequena da matéria, que contém as mesmas características da mesma matéria tem o nome de molécula.
O QUE É UMA MOLÉCULA ?
Uma molécula é formada quando átomos do mesmo ou diferentes elementos se combinam. A molécula é a menor partícula de uma substância que pode normalmente existir de maneira independente.
Exemplos:
- Dois átomos de oxigênio se combinam para formar uma molécula de oxigênio [O2].
- Um átomo de carbono se combina com dois átomos de oxigênio para formar uma molécula de dióxido de carbono [CO2].
O QUE É UM COMPOSTO ?
Um composto é formado quando átomos ou moléculas de diferentes elementos se combinam. Em um composto, os elementos estão quimicamente combinados em uma proporção fixa.
Exemplos:
Exemplos:
- Hidrogênio e oxigênio são combinados na proporção fixa de 2:1 para formar o composto água [H2O].
- Carbono e oxigênio são combinados na proporção fixa de 1:2 para formar o composto dióxido de carbono [CO2].
ELEMENTOS E A TABELA PERIÓDICA:
Todos os corpos são naturalmente constituídos por moléculas e estas constituídas por átomos. Estes átomos, ou elementos, em determinadas quantidades e formas dão origem aos compostos da natureza, desde ao composto mais simples como a água, por exemplo, até a compostos super complexos, como o ser humano.
Afim de organizar os átomos pela sua carga nuclear, a carga do núcleo, que como já vimos é constituída por partículas de carga positiva e de carga neutra, foi criada a tabela periódica que apresento já de seguida:
Tabela periódica dos Elementos
Como podemos verificar os elementos estão, entre outras organizações, organizados pelo seu número atômico ou carga nuclear
(número de protões do núcleo) – assinalados na figura com um círculo a amarelo. O H (hidrogênio) tem número atômico = 1,
o He (hélio) número atômico = 2,
o Li (lítio) número atômico = 3 e assim sucessivamente.
A tabela periódica também ordena os elementos pela quantidade de electrões distribuídos nas suas órbitas. Quero dizer com isto que os elementos da primeira linha (as linhas são sempre as horizontais e as colunas as verticais), têm todos só uma nuvem eletrônica, os da segunda linha, duas nuvens eletrônicas e assim sucessivamente. No que diz respeito às colunas, os da coluna I (vertical) têm todos só um electrão de valência, os da coluna II, dois electrões de valência, os da coluna III, três electrões de valência e assim sucessivamente. Todas estas características são válidas para todos os elementos, excepto para o Hélio (He).
Além de todas estas organizações da tabela periódica, há a salientar também a organização dos elementos pelas suas características de condutibilidade, ou seja, os elementos mais ou menos condutores de eletricidade. Sendo assim, e para exemplificar o que foi dito tanto no parágrafo anterior (sobre as nuvens eletrônicas e os electrões de valência), tal como para mostrar a organização dos elementos por condutibilidade, mostro a seguir um excerto da tabela periódica:
Tabela Periódica com os Electrões e as Órbitas
Verificando os elementos das linhas 1, 2, 3, pode-se dizer que todos os elementos da linha 2 têm duas nuvens eletrônicas, os da linha 3 têm três nuvens eletrônicas, e assim sucessivamente.Verificando agora as colunas, podemos constatar que os elementos da coluna I, o Lítio e o Sódio por exemplo, têm 1 electrão na última camada eletrônica. Os da coluna II, o Berílio e o Magnésio por exemplo, têm dois electrões de valência, e assim sucessivamente.
Podemos ainda classificar os elementos da Tabela Periódica em três grandes grupos (excluindo o Hidrogênio que tem uma posição especial entre todos os elementos):
- Metais – São os elementos das colunas I, II e III. São bons condutores eléctricos como se pode depreender do nome que têm. Como têm poucos electrões de valência, estes cedem facilmente esses poucos electrões.
- Não Metais – São os elementos das colunas IV, V e VI. Como o nome sugere, são maus condutores de eletricidade por conterem mais do que 4 electrões de valência.
- Gases Nobres – São os elementos da coluna VIII.
Além destes três grandes grupos temos ainda os metaloides que são elementos com propriedades entre os metais e os não-metais. Estes elementos estão localizados numa zona fronteiriça mal delimitada. Como exemplo temos elementos muito importantes como o silício, o germânio, o arsênio, etc, elementos muito importantes em eletrônica.
Voltando aos prótons e elétrons é já do conhecimento que eles mesmo sendo de tamanhos microscópicos, dão bastante solidez aos materiais. A sua atração e a velocidade inimaginável que os electrões se deslocam, fazem com que estejam em todas as partes ao mesmo tempo, anulando assim o espaço vazio com a sua imensa velocidade. O protão e o electrão, mesmo tendo tamanhos diferentes, atraem-se exatamente com a mesma força.
Dois corpos com a mesma carga repelem-se e dois corpos com cargas opostas atraem-se. Ou seja se tivermos dois protões ou dois electrões, estes vão-se “afastar”.
Estado neutro de um átomo é quando este tem o mesmo número de protões e o mesmo número de electrões, ou seja, o mesmo número de cargas positivas e o mesmo número de cargas negativas.
Quando um átomo tem o mesmo número de protões e o mesmo número de electrões diz-se que está equilibrado e diz-se que está desequilibrado quando isto não se verifica.
Pode-se ainda dizer que, quando um átomo ganha electrões, ou seja, quando ganha partículas negativas, fica logicamente com mais cargas negativas do que positivas. Podemos então dizer que se trata de um ião negativo por estar carregado negativamente. Quando perde electrões, fica então com mais protões do que electrões, ou seja, fica com mais cargas positivas do que negativas, recebendo o nome de ião positivo.Estes iões tendem a ficar num estado neutro, ou seja, os iões negativos tendem a perder o electrão que está a mais e os iões positivos tendem a captar os electrão que têm em falta.
Fonte: https://www.tecnologiadoglobo.com/2009/03/materia-atomos-protoes-electroes-tabela-periodica/
https://www.colegioweb.com.br/quimica/numero-atomico-e-numero-de-massa.html
Questões
1) (STA. CASA) A questão deve ser respondida de acordo com o seguinte código:A teoria de Dalton admitia que:
I. Átomos são partículas discretas de matéria que não podem ser divididas por qualquer processo químico conhecido;
II. Átomos do mesmo elemento químico são semelhantes entre si e têm mesma massa;
III. Átomos de elementos diferentes têm propriedades diferentes.
a) Somente I é correta.
b) Somente II é correta.
c) Somente III é correta.
d) I, II, III são corretas.
e) I e III são corretas.
2) (MACK) Indique a alternativa que completa corretamente as lacunas do seguinte período: “Um elemento químico é representado pelo seu ___________ , é identificado pelo número de __________ e pode apresentar diferente número de __________ .”
a) nome – prótons – nêutrons.
b) nome – elétrons – nêutrons.
c) símbolo – elétrons – nêutrons.
d) símbolo – prótons – nêutrons.
e) símbolo – – elétrons – nêutrons.
3) (FUVEST) O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 17
4) Qual o número de tipos de moléculas diferentes em um grande reservatório de gás cloro?
Dados:
a) O gás cloro tem forma molecular Cl2, isto é, ele tem dois átomos de cloro por molécula;
b) O cloro apresenta dois isótopos naturais: Cl35 e Cl37.
5) (PUC) Quando um metal cristaliza no sistema cúbico de faces centradas, seu número de coordenação, isto é, o número de átomos que envolve cada átomo, será igual a:
a) 3
b) 4
c) 6
d) 8
e) 12
6) Assinale V (verdadeira) ou F (falsa) para as questões relacionadas ao átomo de Böhr:
I. Quando o elétron recebe energia, salta para um nível mais energético.
II. Quando o núcleo recebe energia, salta para um nível mais externo.
III. Se um elétron passa do estado A para o estado B, recebendo X unidades de energia, quando voltar de B para A devolverá X unidades de energia na forma de ondas eletromagnéticas.
IV. Quando um elétron passa de um estado menos energético para outro mais energético, devolve energia na forma de ondas eletromagnética.
7) Böhr estabeleceu em sua teoria atômica que os elétrons giram em 7 órbitas circulares denominadas níveis ou camadas ao redor do núcleo, como mostra a seguinte ilustração:

Segundo Böhr, o átomo pode ter no máximo 7 camadas. Qual delas é a mais energética?
a) camada K
b) camada L
c) camada N
d) camada P
e) camada Q.
c) camada N
d) camada P
e) camada Q.
8) Escolha, dentre as alternativas, aquela que fornece as palavras corretas para preencher as lacunas vazias do enunciado relacionado ao modelo atômico estabelecido por Böhr.
Quando um elétron absorve certa quantidade de ................., salta para uma órbita mais ....................... Quando ele retorna à sua órbita original, .................... a mesma quantidade de energia, na forma de ........................
a) calor, energizada, libera, onda eletromagnética.
b) energia, energética, absorve, onda eletromagnética.
c) calor, energizada, absorve, luz.
d) energia, energética, libera, onda eletromagnética.
e) energia, externa, libera, luz.
9) (UFU-MG) O átomo é a menor partícula que identifica um elemento químico. Ele possui duas partes, a saber: uma delas é o núcleo, constituído por prótons e nêutrons, e a outra é a região externa – a eletrosfera-, por onde circulam os elétrons. Alguns experimentos permitiram a descoberta das características das partículas constituintes do átomo.
Em relação a essas características, indique a alternativa correta.
a) prótons e elétrons possuem massas iguais e cargas elétricas de sinais opostos.
b) entre as partículas atômicas, os elétrons têm maior massa e ocupam maior volume no átomo.
c) entre as partículas atômicas, os prótons e os nêutrons têm maior massa e ocupam maior volume no átomo.
d) entre as partículas atômicas, os prótons e os nêutrons têm mais massa, mas ocupam um volume muito pequeno em relação ao volume total do átomo.
10) (UFRJ) Alguns estudantes de Química, avaliando seus conhecimentos relativos a conceitos básicos para o estudo do átomo, analisam as seguintes afirmativas:
I. Átomos isótopos são aqueles que possuem mesmo número atômico e números de massa diferentes.
II. O número atômico de um elemento corresponde à soma do número de prótons com o de nêutrons.
III. O número de massa de um átomo, em particular, é a soma do número de prótons com o de elétrons.
IV. Átomos isóbaros são aqueles que possuem números atômicos diferentes e mesmo número de massa.
V. Átomos isótonos são aqueles que apresentam números atômicos diferentes, número de massas diferentes e mesmo número de nêutrons.
Esses estudantes concluem, corretamente, que as afirmativas verdadeiras são as indicadas por:
a) I, III e V
b) I, IV e V
c) II e III
d) II, III e V
e) II e V
11) (UFCE) Na tentativa de montar o intrincado quebra-cabeça da evolução humana, pesquisadores têm utilizado relações que envolvem elementos de mesmo número atômico e diferentes números de massa para fazer a datação de fósseis originados em sítios arqueológicos. Quanto a esses elementos, é correto afirmar que são:
a) isóbaros
b) isótonos
c) isótopos
d) alótropos
e) isômeros
12) (PUC-PR) Dados os átomos de 238U92 e 210Bi83, o número total de partículas (prótons, elétrons e nêutrons) existentes na somatória será:
a) 641 b) 528 c) 623 d) 465 e) 496
13) (UFPA) Com relação as partículas subatômicas, prótons, nêutrons e elétrons, podemos afirmar que :
a) todas têm carga negativa
b) todas têm carga positiva
c) todas estão localizadas no núcleo atômico
d) todas estão localizadas na eletrosfera
e) prótons e nêutrons estão localizados no núcleo.
14) (FUVEST) A seguinte representação , onde X = símbolo do elemento químico, refere-se a átomos com:
a) Igual número de nêutrons;
b) Igual número de prótons;
c) Diferentes números de elétrons;
d) Diferentes números de atômicos;
e) Diferentes números de oxidação;
15) (PUC) Quando um metal cristaliza no sistema cúbico de faces centradas, seu número de coordenação, isto é, o número de átomos que envolve cada átomo, será igual a:
a) 3
b) 4
c) 6
d) 8
e) 12
16) Um elemento químico é caracterizado por seu:
a) número de nêutrons.
b) número atômico.
c) número de elétrons.
d) número de massa.
e) lugar na tabela periódica.
17) Dentre os números atômicos 23, 31, 34, 38, 54, os que correspondem a elementos químicos com dois elétrons de valência são:
a) 23 e 38
b) 31 e 34
c) 31 e 38
d) 34 e 54
e) 38 e 54
18) Átomos isótopos diferem quanto:
a) às configurações eletrônicas.
b) às posições, na classificação periódica.
c) aos números atômicos.
d) aos números de elétrons.
e) aos números de nêutrons.
19) Assinale a afirmativa correta:
a) é possível calcular a posição e a velocidade de um elétron, num mesmo instante - Princípio de Certeza
b) um subnível comporta no máximo dois elétrons, com spins contrários - Princípio da Exclusão de Pauli
c) orbital é a região do espaço onde é mínima a probabilidade de encontrar um determinado elétron
d) em um átomo, os elétrons encontram-se em órbitas quantizadas, circulares e elípticas - Modelo Atômico de Sommerfeld.
20) O conhecimento sobre estrutura atômica evoluiu à medida que determinados fatos experimentais eram observados, gerando a necessidade de proposição de modelos atômicos com características que os explicassem.Fatos Observados:
I - Investigações sobre a natureza elétrica da matéria e descargas elétricas em tubos de gases rarefeitos.
II - Determinação das Leis Ponderais das Combinações Químicas.
III - Análise dos espectros atômicos (emissão de luz com cores características para cada elemento).
IV - Estudos sobre radioatividade e dispersão de partículas alfa.
Características do Modelo Atômico:
1 - Átomos maciços, indivisíveis e indestrutíveis. 2 - Átomos com núcleo denso e positivo, rodeado pelos elétrons negativos. 3 - Átomos como uma esfera positiva onde estão distribuídas, uniformemente, as partículas negativas. 4 - Átomos com elétrons, movimentando-se ao redor do núcleo em trajetórias circulares - denominadas níveis - com valor determinado de energia. A associação correta entre o fato observado e o modelo atômico proposto, a partir deste subsídio, é:
a) I - 3; II - 1; III - 2; IV - 4.
b) I - 1; II - 2; III - 4; IV - 3.
c) I - 3; II - 1; III - 4; IV - 2.
d) I - 4; II - 2; III - 1; IV - 3.
e) I - 1; II - 3; III - 4; IV - 2.
21) Os átomos ISÓBAROS X e Y2O3 pertencem a metal alcalino e alcalino-terroso do mesmo período da classificação periódica. Sabendo-se que X é formado por 37 prótons e 51 nêutrons, pode-se afirmar que os números atômicos e de massa de Y2O3 são, respectivamente,
a) 36 e 87
b) 37 e 87
c) 38 e 87
d) 38 e 88
e) 39 e 88
22) Com relação à estrutura do átomo, assinalar a alternativa correta:
a) o átomo é maciço
b) a massa do átomo está fundamentalmente concentrada no seu núcleo
c) no núcleo encontram-se prótons e elétrons
d) a massa do elétron é igual à massa do próton
e) átomos de um mesmo elemento químico são todos iguais
23) No fim do século XIX começaram a aparecer evidências de que o átomo não era a menor partícula constituinte da matéria. Em 1897 tornou-se pública a demonstração da existência de partículas negativas, por um inglês de nome:
a) Dalton;
b) Rutherford;
c) Bohr;
d) Thomson;
e) Proust.
24) Associe corretamente as colunas abaixo:
I. Metais alcalinos ( ) Grupo 0
II. Metais alcalinoterrosos ( ) Grupo 17 ou VII A
III. Calcogênios ( ) Grupo 16 ou VI-A
IV. Halogênios ( ) Grupo 15 ou V-A
V. Família do carbono ( ) Grupo 14 ou IV-A
VI. Família do nitrogênio ( ) Grupo 1 ou I-A
VII. Gases nobres ( ) Grupo 2 ou II-A
25) (UFU-MG) No início do século XIX, com a descoberta e o isolamento de diversos elementos químicos, tornou-se necessário classificá-los racionalmente para a realização de estudos sistemáticos. Muitas contribuições foram somadas até se chegar à atual classificação periódica dos elementos químicos. Em relação à classificação periódica atual, responda:
a) Como os elementos são listados, sequencialmente, na tabela periódica?
b) Em quais grupos da tabela periódica podem ser encontrados: um halogênio, um metal alcalino, um metal alcalinoterroso, um calcogênio e um gás nobre?
26) (UFPel-RS) Os elementos químicos silício e germânio são semimetais e constituem os chamados semicondutores, usados para construir componentes eletrônicos, como iodos, transistores e microprocessadores.
Algumas das qualidades desses elementos devem-se às suas estruturas atômicas. Com relação ao silício e ao germânio e à posição que eles ocupam na tabela periódica, podemos afirmar que:
a) se situam no mesmo período da tabela periódica e apresentam configuração final “ns2 np4”;
b) pertencem à mesma família da tabela periódica, possuindo, portanto, o mesmo número de níveis eletrônicos;
c) pertencem à classe dos elementos representativos da família do carbono, possuindo em comum o mesmo número de elétrons de valência;
d) são elementos de transição e apresentam subnível energético do tipo “p”;
e) apresentam o mesmo número de níveis eletrônicos, possuindo, portanto, o mesmo raio atômico.
Gabarito:
1) D 2) D 3) D 4) Cada Cl2 é formado por dois átomos quaisquer de cloro:
Cl35 – Cl35 Cl35 – Cl37 Cl37 – Cl37
Essas moléculas são quimicamente iguais, porém fisicamente diferentes.
Resp: Fisicamente temos 3 tipos de moléculas e quimicamente temos um único tipo de molécula.
5) A 6) I. verdadeira II. falsa III. verdadeira IV. falsa 7) E 8) D 9) D 10) B 11) C
12) Letra C. Vamos calcular primeiro o número de nêutrons para os dois elementos, usando a fórmula
n = A – Z
238U92 238 -92 = 146
210Bi83 210 – 83 = 127
Soma dos nêutrons: 146 + 127 = 273
De acordo com a fórmula P = Z = e temos:
Soma dos prótons: 175
Soma dos elétrons: 175
A soma total (de prótons, elétrons e nêutrons) para os dois elementos será = 623
13) E 14) B 15) A 16) B 17) A 18) E 19) D 20) C 21) D 22) B 23) D
24) I. Metais alcalinos (VII) Grupo 0
II. Metais alcalinoterrosos (IV) Grupo 17 ou VII A
III. Calcogênios (III) Grupo 16 ou VI-A
IV. Halogênios (VI) Grupo 15 ou V-A
V. Família do carbono (V) Grupo 14 ou IV-A
25) a) Em ordem crescente de número atômico (número de prótons).
b) Os halogênios são encontrados na família 17 (VII A); os metais alcalinos na família 1 (I A); os metais alcalinoterrosos na família 2 (II A); os calcogênios na família 16 (VI A) e os gases nobres na família 18 (VIII A).
VI. Família do nitrogênio (I) Grupo 1 ou I-A
VII. Gases nobres (II) Grupo 2 ou II-A
26) C
- Início
- contato
- VIVA
- AR
- ÁGUA
- LINKS IMPORTANTES
- mensagens do professor
- TRABALHOS
- CAL
- CIENCIA
- EXPERIMENTOS
- PH
- COMBUSTIVEIS
- TEORIAS ATOMICAS
- PROVAS DO ENEM CORRIGIDAS
- TRANSFORMAÇÕES QUÍMICAS
- TRANSFORMAÇÕES FÍSICAS
- EXERCÍCIOS SOBRE MISTURAS
- MISTURAS
- DISTRIBUIÇÃO ELETRÔNICA
- ÁTOMO
- QUÍMICA VIVA
- VARIEDADES ALOTRÓPICAS DO CARBONO
- ALUNOS DA 8º SÉRIE
- ECONOMIZAR ÁGUA
- AMIANTO
- A RADIOATIVIDADE QUE SALVA VIDAS
- A QUÍMICA DO AÇÚCAR
- "ÓXIDO NITROSO" TUDO A VER COM O AMOR
- OS METAIS E A SAÚDE HUMANA
- ALUMÍNIO
- EXERCÍCIOS DE ATOMISTICA
- DESAFIOS
- TABELA PERIÓDICA
- REFRIGERANTES
- VIAGRA
- LAVOISIER
- EXERCÍCIOS DE LIGAÇÕES QUÍMICAS
- GEOMETRIA MOLECULAR
- EXERCÍCIOS
- EXERCÍCIOS SOBRE TABELA PERIÓDICA
- EXERCÍCIOS SOBRE FUNÇÕES INORGÂNICAS
- (Página sem titulo)
- ESTEQUIOMETRIA
- BALANCEAMENTO
- EXERCÍCIOS ISOMERIA PLANA
- EXERCÍCIOS MISTURAS 2016
- LIGAÇÃO QUÍMICA
- EVOLUÇÃO DOS MODELOS ATÔMICOS
- FUNÇÕES INORGÂNICAS
- CINÉTICA QUÍMICA
- ELETROQUÍMICA
- Contactos
Total de visitas: 146482





